Cours spectroscopie infrarouge
1 Spectroscopie Infrarouge
1.5 Les molécules en vibration suite 2
Il dépend de :
- la masse réduite μ du système A-B
- la constante de force de la liaison
Effet de k
Fréquence de vibration proportionnelle à k
Effet de μ
Fréquence de vibration inversement proportionnelle à μ
II.1.3 Energie de vibration
Pour décrire les forces agissant sur une liaison en vibration, on utilise l’énergie potentielle d’un oscillateur harmonique :
La courbe d’énergie potentielle en fonction de (r-r0) est une parabole.
II.1.4 Situation réélle des molécules
En réalité la forme du potentiel n’est pas rigoureusement parabolique mais suit la fonction de Morse :
Energie d'un oscillateur harmonique, modèle utilisé pour étudier les vibrations des molécules de type A-B
La courbe de l’énergie potentielle est assimilée à la parabole de l’oscillateur harmonique pour des vibrations de faibles amplitudes.
a) Aspect quantique
Cas de l’approximation harmonique
L’équation de Schrödinger selon la direction x :
Solution : Ev = hν (v+1/2)
v : nombre quantique de vibration (v = 0, 1, 2..)
ν : fréquence de vibration (modèle classique)
Niveaux de vibration équidistants
ΔEV = constante = hv
Les Liaisons ne sont pas des ressorts parfaits.
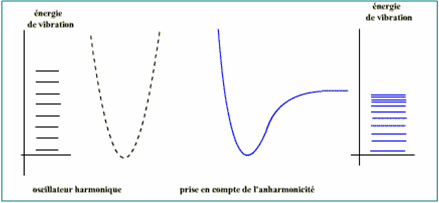
Les Niveaux de vibration de plus en plus rapprochés.
II.1.5 - Règles de sélection
Loi de Bohr hn = ΔE doit être vérifiée.
variation du moment dipolaire de la molécule
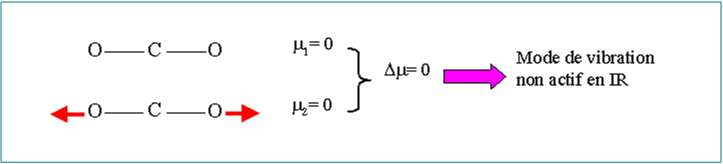
L’intensité absorbée est d’autant plus grande que la variation du moment dipolaire est grande.
II.1.6 Restriction quantique
Règle de sélection entre niveaux vibrationnels de nombres quantiques v : Δv = ± 1 + : absorption - : émission

Seul le niveau v=0 est significativement peuplé.
L'absorption observée résultera de la transition
v=0 → v=1.
II.1.7 - Rotation-vibration - Structure fine
Structure fine

