Polymérisations en chaîne
Dans ce chapitre, nous traitons les différentes polymérisations en chaîne.
- Polymérisation radicalaire
- Polymérisation anionique
- Polymérisation cationique
| Site: | Touch By SukaJanda01 |
| Cours: | CHIM3521 : Chimie des polymères organiques et inorganiques |
| Livre: | Polymérisations en chaîne |
| Imprimé par: | Visiteur anonyme |
| Date: | mardi 17 juin 2025, 17:55 |
Table des matières
1 Généralités sur la polymérisation Radicalaire
La polymérisation radicalaire
La polymérisation radicalaire consiste en une réaction entre radicaux pour former une longue chaîne.
Elle comporte les trois étapes:
- Amorçage, - Propagation et - Terminaison
Avantage de la polymérisation radicalaire
1. Pas de conditions expérimentales très contraignantes
2. Permet la polymérisation d’une grande variété de monomères même fonctionnalisés
3. Milieu homogène ou hétérogène
4. Large gamme de température utilisable
5. Large gamme de solvants (milieu organique ou milieu aqueux)
6. Processus facilement industrialisable
Inconvénients la polymérisation radicalaire
1. Pas de contrôle de la taille (masse molaire) des macromolécules
2. Pas de contrôle de la structure (architecture) des macromolécules
3. Indices de polymolécularité élevés
2 Les différentes étapes de la polymérisation radicalaire
2.1 Mécanisme de polymérisation comporte trois étapes principales :
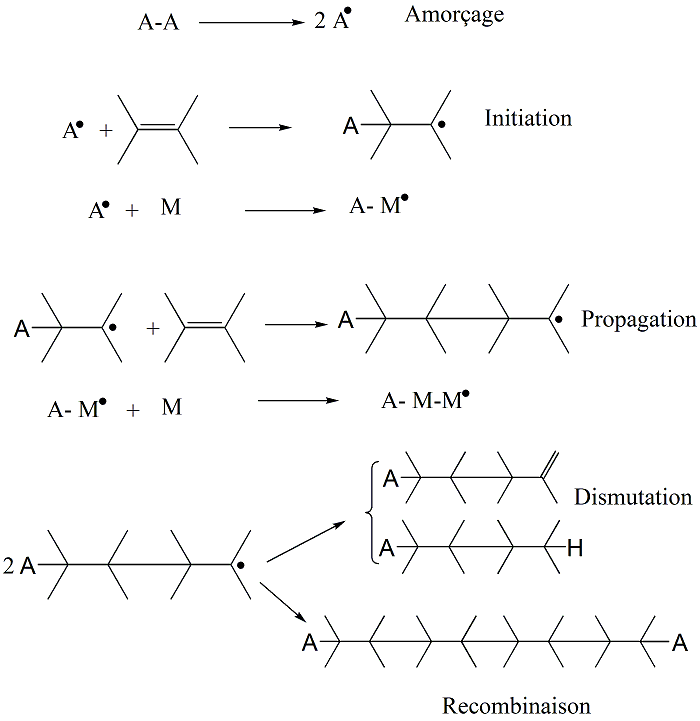
Etape d’amorçage : étape généralement lente qui permet de créer l’espèce radicalaire active
Etape de propagation : étape qui permet la formation de la chaîne macromoléculaire
Etape de terminaison : étape de rencontre entre deux radicaux et «mort » de la macromolécule

2.1 Cinétique de la polymérisation radicalaire
2.1 Cinétique de la polymérisation radicalaire

Exemple
2.2 Equations cinétques de la polymérisation radicalaire
Va: Vitesse d'amorçage; Vd: Vitesse de dissociation; Kd: Constante de dissociation; M: Monomère
A: amorceur; A*: Radical amorceur
Kp: Constante de vitesse de propagation;
Kt: Constante de vitesse de terminaison
Remarque
La vitesse de polymérisation est la somme de la vitesse d'amorçage et de la vitesse de propagation.
Le nombre de molécules de monomères intervenant dans l'étape d'amorçage est extrêmement faible comparé à celui à ceux consommé dans l'étape de propagation. En conséquence; Vp = Vpr
Expression de la vitesse de polymérisation :
Hypothèse de l’état stationnaire (EQS): tout se qui s’amorce se « termine »
En conséquence :
La vitesse de propagation est proportionnelle à :
- la concentration en amorceur [A2]½
- la concentration en monomère
2.3 Définition de la longueur de chaîne cinétque
Longueur de chaîne cinétique ν : Nombre moyen de réactions élémentaires
(addition de molécules de monomères) par
centre actif (radical).
La vitesse de polymérisation vp mesure le nombre moyen de molécules de
monomères additionnées par molécule d’amorceur par unité de temps :
Relation existant entre la longueur de la chaîne cinétique et le degré de polymérisation DPn
Relation entre ν et le degré de polymérisation xn :
Dpn = ν/x
x est un facteur qui tient compte du mode de terminaison de la chaîne durant la polymérisation
x = 0,5 ou x =1
Pour une terminaison par dismutation Pour une terminaison par recombinaison
x = 1 x = 0,5
La longueur de chaîne cinétique La longueur de chaîne cinétique
est égale à la longueur de est égale à la moitié de la
chaîne matérielle longueur de chaîne matérielle
2.4 Problèmes liés aux réactions de terminaison
Les réactions de terminaison ont un effet sur les polymères obtenus
- Le premier effet concerne la taille maximale que vont pouvoir atteindre les polymères. La longueur de la chaîne cinétique suit la loi :
La longueur de chaîne cinétique est proportionnelle à (kp/kt)1/2.En conséquence, la présence de réactions de terminaison limite la taille des macromolécules qui peuvent être synthétisées.
- Le second effet concerne la polymolécularité des polymères
Amorçage lent / Propagation rapide / Terminaison rapide
Une chaîne amorcée en début de polymérisation (concentration en monomère importante) sera plus longue qu’une chaîne amorcée en fin de polymérisation.
En conséquence la distribution de masses molaires est large (indice de polymolécularité toujours supérieur à 1,5).
- Le dernier effet concerne la nature du polymère obtenu (architecture). Les réactions de terminaison sont irréversibles. Elles conduisent à la formation de macromolécules qui ne peuvent pas reprendre leur croissance. En conséquence, l’accès à des architectures complexes (copolymères à blocs, greffés, en étoile, …) est impossible.
En résumé :
- Pas de contrôle de la taille (masse molaire) des macromolécules
- Pas de contrôle de la structure (architecture) des macromolécules
- Indices de polymolécularité élevés
2.5 Problème liés aux réactions de transfert
Qu’est ce que les réactions de transfert ??
Réactions supplémentaires par rapport aux étapes classiques (amorçage, propagation et terminaison) de la polymérisation radicalaire.
Elles correspondent à des réactions entre la chaîne en croissance avec différentes espèces moléculaires présentes dans le milieu : amorceur, monomère, solvant, …
Elles produisent une interruption de la chaîne matérielle sans interruption de la chaîne cinétique.
Influence des réactions de transfert sur le degré de polymérisation
En absence de réaction de transfert, xn est relié à ν par l’expression :
En présence de réactions de transfert, xn est relié à ν par l’expression :
donc on a
On obtient une expression générale qui relie le degré de polymérisation à la longueur de la chaîne cinétique et aux différentes constantes de transfert de chaîne :
En introduisant la valeur de ν on obtient :
Problèmes liés au transfert

Origine des inconvénients de la polymérisation radicalaire conventionnelle
Les inconvénients de la polymérisation radicalaire découlent :
des réactions de terminaison
• influence sur la masse molaire du polymère synthétisé
• impossibilité d’accéder à des architectures complexes des réactions de transfert
• influence sur la masse molaire du polymère synthétisé
• architectures non souhaitées obtenues
Ces inconvénients sont :
Pas de contrôle de la taille (masse molaire) des macromolécules
Pas de contrôle de la structure (architecture) des macromolécules
Indices de polymolécularité élevés (Ip > 1,5)
3 La polymérisation radicalaire contrôlée
Généralités
Les réactions de terminaison et de transfert sont dues à une concentration
en radicaux trop importante.
Comment limiter les réactions de terminaison ?
Pour limiter les réactions de terminaison (ou de transfert), il faut une concentration faible en radicaux dans le milieu réactionnel.
Dans ce cas, Il convient de protéger une fraction de radicaux sous une forme inerte en
établissant un équilibre :
Idéalement, les chaînes macromoléculaires sont toutes créées très rapidement en début de polymérisation et croissent simultanément pendant des minutes ou des heures suivant une succession de cycles d’activation-désactivation.
3.1 Mécanisme de polymérisation radicalaire contrôlée :
Amorçage rapide et quantitatif !!
Réactions de terminaison minimisées !!
A tout instant, l’équilibre est fortement déplacé vers les espèces dormantes (10-3-10-1 mol.l-1) et la concentration instantanée en radicaux propagateurs reste comparativement très faible (10-9-10-7 mol.l-1).
Cette désactivation réversible peut provenir :
• d’une réaction de terminaison réversible
polymérisation radicalaire contrôlée par transfert réversible par
addition-fragmentation (RAFT/MADIX)
A la fin de la polymérisation contrôlée les polymères se retrouvent sous leur forme dormante Mn-X.
Si on ajoute un autre monomère M dans le milieu et que l’on réactive l’espèce dormante, le polymère va reprendre sa croissance et on aura formé au final un copolymère à blocs de type Mn-b-Mp-X.
3.2 Suite
L’effet de radical persistant
L’effet radical persistant concerne la polymérisation radicalaire contrôlée par terminaison réversible (NMP ou ATRP).
X* est appelé agent de contrôle ( ) X est appelé agent de contrôle ( ).
Que dire de X*??
Il doit s’additionner sur les radicaux en croissance Mn*
Il doit permettre la « régénération » de l’espèce active Mn*
Il ne doit pas disparaître dans des réactions parasites telles qu’une addition sur une molécule de monomère ou par dimérisation. Il doit donc être inactif face aux espèces non radicalaires et face à lui même.
X* est un radical persistant.
Il existe deux types d’espèces radicalaires :
Les radicaux fugaces : Ce sont des espèces extrêmement réactives. Leur durée de vie est inférieure à 10-3 secondes.
Les radicaux persistants : Ce sont des espèces « stables » qui ne réagissent pas avec elles mêmes mais qui peuvent réagir avec les radicaux fugaces ou avec d’autres radicaux persistants.
3.3 Polymérisation radicalaire
Principe général de la croissance des chaînes
Schéma général
Amorçage, propagation, terminaison ou transfert sont des événements indépendants les uns des autres. Le processus de polymérisation, et donc la longueur de la macromolécule, englobe l'ensemble de ces événements élémentaires.
Formation des radicaux primaires et amorçage
Ne pas confondre formation des radicaux primaires et réaction d'amorçage :
Les radicaux primaires A° sont généralement obtenus par décomposition homolytique d'un amorceur.
Amorçage chimique : décomposition thermique ou redox d'un amorceur
Amorçage photochimique : décomposition photochimique d'un amorceur
Les radicaux peuvent aussi être obtenus par
Amorçage radiochimique : coupure homolytique de l'amorceur sous l'action d'un rayonnement e-,
Amorçage thermique : coupure homolytique du monomère sous l'action de la chaleur sans amorceur
L'amorçage consiste en la réaction d'un radical primaire avec la première molécule de monomère. La vitesse d'amorçage dépendra de la vitesse d'apparition des radicaux primaires.
3.4 Formation des radicaux primaires
Décomposition thermique d'un amorceur chimique
Azobisisobutyronitrile (AIBN)
Peroxyde de benzoyle (POB)
Réaction redox
Sel de Fenton
3.5 Amorçage
Efficacité de l'amorceur f < 1
v En général, radical porté par le carbone le plus substitué : addition tête - queue
3.8 Longueur de la chaine cinétique
La longueur de la chaine cinétique peut être définie comment étant le nombre de molécules (motifs) de l'amorçage jusqu'à la terminaison.
3.9 Cinétique de polymérisation
Amorçage : formation d’un radical
Théorie de l'état quasi - stationnaire : [M*] = constante
cas d'un amorceur chimique
1 – cinétique de décomposition de l'amorceur
Formation continue de nouveaux radicaux, donc de nouvelles chaînes, pendant toute la durée de la réaction
2 - Temps de vie des centres actifs très court
Accumulation de nouvelles chaînes "terminées" dans le milieu réactionnel
3.10 Réactions de transfert
Le centre actif est transféré sur une autre espèce : il n'est pas détruit
Arrêt de la chaîne en croissance : diminution des masses molaires moyennes
- transfert voulu par addition d'un agent de transfert pour baisser les Masses Molaires
thiols : dodécylthiol C12H25SH, acide thioglycolique HSCH2COOH …
dérivés halogénés : CHCl3, dérivé bromé …
- transfert subi si agent de transfert = composante du système :
solvant, monomère,
polymère ® alors polymère ramifié et MMä : PEbd, PVAc…)
Exemples de constantes de transfert Ctr
MMA chloroforme : 10-4 styrène : chloroforme : 0,5. 10-4
toluène : 0,2. 10-4 toluène : 0,1. 10-4 C12H25SH : 15
CCl4 : 5. 10-4 CCl4 : 90. 10-4
Les réactions de transfert dépendent aussi beaucoup de la température, avec des énergies d’activation assez élevées, de l’ordre de 50 kJ/mol.
La croissance des chaînes est arrêtée soit par terminaison, soit par transfert.
Nombre de chaînes = chaînes arrêtées par terminaison + chaînes arrêtées par transfert
Équation de Mayo :
Contrôle des masses molaires
Le contrôle des masses molaires est régi par l’équation de Mayo :
avec Xn degré de polymérisation, Xn0 degré de polymérisation en l’absence de réactions de transfert,
Cm constante de transfert sur le monomère,
constante de transfert sur l’agent i dont la concentration est [Si].
1 ⁄ Xn = 1 ⁄ Xn0 + Cm + CSi [Si] ⁄ [M]
Xn Degré de polymérisation
Xn0 degré de polymérisation en l’absence de réactions de transfert
Cm constante de transfert sur le monomère
CSi Constante de transfert sur l’agent i dont la concentration est [Si].
Télomérisation
Utilisation d'une concentration importante d'un agent de transfert non dégradant (télogène)
- un peu d'AIBN pour amorcer la réaction
- beaucoup de transfert sur le télogène suivi d'un réamorçage
Formation d'un télomère : oligomère (polymère de faible ) fonctionnalisé
Cette méthode permet donc aussi la formation de polymères fonctionnalisés
4.1 L'amorçage
On utilise des bases fortes, pour créer ensuite des anions.
Bases Solvants possibles
NH2- NH3
RO- ROH
Organométallique THF
Exemple de polymérisation anionique
ensuite
Différents amorceurs basiques (nucléophiles) peuvent être utilisés.Cependant, les bases classiques sont en général trop faibles, sauf pour l'amorçage de monomères renfermant des groupes fortement électroattractifs.
Exemple
Les bases plus fortes, sont les dérivés organométalliques tels que les butyllithiums :
4.2 Propagation de la chaine anionique
Propagation de la chaine anionique
Dans le THF, la polymérisation des monomères vinyliques est très rapide en raison de la présence d'ions libres beaucoup plus réactifs en équilibre avec les paires d'ions.
Dans les solvants non polaires (hydrocarbures), il n'y a pas d'ions libres.
4.3 Terminaison anionique
Les réactions de terminaison peuvent être provoquées par des réactifs électrophiles comme : acides, dérivés halogénés, etc... Si leur concentration est supérieure à celle de l'amorceur, la polymérisation ne peut pas avoir lieu. C'est pourquoi les précautions particulières doivent être prises : absence d'eau, d'oxygène, de gaz carbonique, etc... qui réagissent très rapidement avec les carbanions en les détruisant :
Les polymérisations anioniques doivent être réalisées avec des réactifs soigneusement séchés et purifiés, et en absence d'air (réactions sous vide ou en atmosphère inerte : N2 , argon ).
La réaction est définitivement arrêtée, et de façon non controlable
Réaction dans un solvant protique : NH3 , ROH
Dans ces conditions, de nombreux monomères se polymérisent sans réactions de terminaison et aussi souvent il y a absence de réactions de transfert. On obtient des centres actifs stables à l'extrémité de toutes les macromolécules.
De tels systèmes sont appelés polymères vivants, car on peut provoquer une nouvelle croissance des macromolécules, par addition, soit du même monomère, soit d'un second monomère.
Dans les systèmes où se forment des polymères vivants, s'il y a un centre actif par macromolécule, on a :
[M] = concentration en monomère consommé
[C] = concentration en centres actifs.
Différences entre les deux types de polymérisation
|
Caractéristique étudiée |
Polymérisation radicalaire |
Polymérisation anionique |
|
Nature des IR |
radicaux |
anions |
|
Terminaisons |
aléatoires et permanentes |
inexistantes en solvant non protogène (polymère« vivant ») |
|
Transferts |
nombreux |
quasi inexistants |
|
Polymolécularité |
élevée (I > 2) |
faible (I < 1,5) et bien définie. |
5 La polymérisation cationique
Les polymérisations sont réalisées en solution
5.1 Amorçage cationique
1 - Amorçage par les acides de Brönstedt :
Acides forts solubles en milieu organique :
acide sulfurique H2SO4 ; acide perchlorique HClO4 ; acide trifluorométhanesulfonique CF3SO3H ; acide trifluoroacétique CF3COOH
L'amorçage a lieu par protonation du monomère
2- Amorçage par les acides de Lewis : BF3 BCl3 AlCl3 TiCl4 SnCl4
comportent une lacune électronique sur le métal (accepteur de doublet électronique).
Amorçage direct
Equilibre d'auto-ionisation de l'acide de Lewis et amorçage par la forme cationique AlCl2+
En fait, processus rare. On utilise souvent un cocatalyseur.
Amorçage par un cocatalyseur générateur de protons, puis amorçage par protonation du monomère
5.2 suite amorçage
Amorçage par un cocatalyseur générateur de carbocations
Exemple: l'amorçage de l'isobutène
5.3 Propagation cationique
Réaction de transfert
Réactions de transfert intramoléculaire
Alkylation de Friedel-Crafts de noyaux aromatiques appartenant au polymère
(réaction intra ou intermoléculaire).
Favorisée à "haute température".
Une double liaison terminale peut être reprotonée pour donner ensuite cette réaction de transfert. A long terme, les chaînes se terminent ainsi
Exemple; la propagation de l'isobutène
Transfert au monomère
5.4 suite propagation cationique
Quand la température diminue, les masses molaires moyennes augmentent
- Stabilité des carbocations : CIII > CII > CI
- Transposition vers un carbocation plus stable
5.5 Terminaison Cationique
Terminaison : couplage cation - anion
D'où la nécessité d'utiliser un contre ion non nucléophile (ClO4- …)
Terminaison : décomposition de l'anion
Nature des centres actifs
contre-ion = dépend de la nature de l'amorceur
Equilibre paire d'ions / ions libres
Équilibre paire d'ions / ions libres :
La concentration de carbocations à un instant t n'est pas connue avec précision